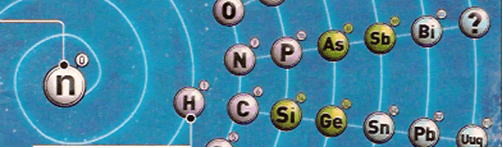
A galáxia química, nome dado a tabela pariódica em forma de espiral, que é uma nova representação do sistema periódico de elementos, desenvolvida por Philip Stewart com base na natureza cíclica das características dos elementos químicos (que depende, principalmente, dos elétrons de valência). Mesmo antes de Dmitri Mendeleev produzir a primeira tabela satisfatória, os químicos estavam fazendo representações em espiral do sistema periódico, e isso tem continuado desde então, mas estes eram geralmente de forma circular. Na galáxia química os elementos são dispostos em uma só espiral, com os com menor número atômico ao centro. Com isso, os períodos doslantanídeos e dos actinídeos, que ficam à parte na tabela, são colocadas em seus lugares sem prejudicar a visualização. No centro do espiral existe o neutrônio, que tem apenas nêutrons em seu núcleo. Na tabela, o hidrogênio fica no grupo 1, a dos metais alcalinos. Na espiral, ele ganhou uma posição nova e isolada, mais próxima do carbono, com o qual ele tem mais semelhanças e frequentemente se combina.
A galáxia química destina-se principalmente a excitar o interesse pela química entre não-químicos, especialmente os jovens, mas é totalmente preciso em termos científicos nas informações que transmite sobre as relações entre os elementos, e tem a vantagem sobre uma tabela de não quebrar a sequência contínua dos elementos. Uma versão revista,Chemical Galaxy II, introduz um novo esquema, inspirado por Michael Laing, para colorir os lantanídeos e os actinídeos, para realçar paralelos com os metais de transição.
John D. Clark foi o primeiro a apresentar uma espiral com um formato oval. Seu design foi utilizado como uma ilustração de duas páginas em cores vivas na revista Life de 16 de maio de 1949. Em 1951, Edgar Longman, um artista, não um químico, pintou um grande mural adaptando a imagem da Life, tornando-a elíptica e inclinando-a para produzir um efeito dinâmico. Philip Stewart, então com 12 anos de idade, havia acabado de ler o livro The Nature of the Universe de Fred Hoyle, e foi inspirado pelo desenho de Longman, que achou se assemelhar a uma galáxia espiral. Stewart voltou a essa ideia muitos anos depois e publicou uma primeira versão de sua galáxia química em Novembro de 2004. Seu desenho visa expressar a ligação entre o mundo minuto dos átomos e a vastidão das estrelas, no interior do qual os elementos foram forjados, como Hoyle foi o primeiro a demonstrar em detalhe.
(Texto adaptado Wikipedia.com)
(Texto adaptado Wikipedia.com)
Porque tais alterações?
1) O modelo é todo circular
: Stewart colocou os elementos em pequenos círculos e,
ligados a eles, outros, menores, com os números
atômicos correspondentes a cada elemento. Segundo ele, “ O cérebro
humano se sente mais confortável com curvas do que com retas”. Mas
conservou as cores originais das famílias dos elementos químicos.

2) O Hidrogênio (H), que na Tabela
de Mendeleiev fica perto dos metais alcalinos, ganhou nova posição, na espiral
- fica colocado em um aro mais central, perto do
Carbono (C) , justificando essa alteração pelo fato de haver
mais afinidade entre o Hidrogênio e o Carbono, com quem
faz ligações com mais facilidade, do que entre o Hidrogênio e o
lítio (Li) , e os metais alcalinos.
3) No centro dos círculos em
espiral, foi colocado um elemento cuja existência está
prevista pelos cientistas, embora ainda não confirmada, e que seria
o Neutrônio, também conhecido como “Elemento Zero”, pois, por
hipótese, possuiria apenas nêutrons em seu núcleo.

Antes do magnífico trabalho de Mendeleïev (1869)
houve outras tentativas de tabelas periódicas de elementos
químicos que não ofereciam uma forma completa de
classificação e apresentação adequada de seu
posicionamento relativo.
A mais conhecida e usada
foi :
1863 – Parafuso
Telúrico , de
Alexandre E. Béguyer Chancourtois :

Consistia
em uma curva helicoidal com 16 partes, que
formavam um cilindro, através de espirais em ordem crescente
da massa atômica. Mas era justamente
a utilização da massa atômica, que pode variar num
mesmo elemento,em determinadas condições , o que
provocava erros impossíveis de regularizar.
Mesmo no modelo de Mendeleïev ainda continuou alguma dificuldade,
pois foi utilizada a massa atômica como ponto de referência, mas a sua
qualidade era tão excelente e tão fácil a leitura, que logo foi
adotada por todos os cientistas e ainda hoje é a única reconhecida
oficialmente pelos órgãos reguladores internacionais , naturalmente com
alguns aperfeiçoamentos, sendo o principal a mudança do ponto de
referência para o número atômico.
Depois de 1869 a Tabela Periódica de Mendeleiev sofreu alguns aperfeiçoamentos, sendo os seguintes os principais, que a levaram à versão atual, que não apresenta mais os antigos problemas :
Depois de 1869 a Tabela Periódica de Mendeleiev sofreu alguns aperfeiçoamentos, sendo os seguintes os principais, que a levaram à versão atual, que não apresenta mais os antigos problemas :
1913
- o número atômico. Henry G. I.
Moseley, após observar que o número de prótons dentro de um
determinado átomo é sempre o mesmo, aperfeiçoou o modelo
mendeleieviano e lhe deu a precisão hoje obtida, corrigindo
todos os problemas que apareciam com a utilização da massa atômica,
substituindo-a pelo número atômico.
1950 - Lantinídios e
Actinídios. Houve
outra modificação na Tabela Periódica de Mendeleïev : seu
autor foi Glenn Seaborg, que descobriu, a partir
do plutônio (descoberto em 1940), os
elementos transurânicos ( números atômicos de 94 a 102).
Para poder incluí-los na Tabela Periódica , reformulou-a,
fazendo a transposição de lantinídios e actinidios (que têm
propriedades semelhantes entre si diversas das dos
outros metais) para um local abaixo do núcleo principal, conservando a
sua localização nas colunas correspondentes às suas famílias .Logrou, com
essa vaga naquele local da Tabela, incluir aqueles novos elementos
que descobrira, ainda restando espaço para outros que vieram
a ser descobertos, dentro dos parâmetros estabelecidos oficialmente, com
um ajuste perfeito. Por esse trabalho recebeu o Prêmio Nobel de
Química de 1951. Foi tão importante a sua contribuição
à Química, que um elemento químico
recém-descoberto recebeu seu nome para
homenageá-lo (Seaborgio), assim como foi feito em
relação a Einstein (Einstênio) , Mendeleïev
(Mendeleievo) , Roentgen, descobridor do Raio X (Roentgênio),
Rutherford, que identificou o próton como componente do núcleo atômico e
previu a existência do nêutron ( Rutherfórdio) e outros renomados cientistas.
Desde então têm aparecido alguns outros
modelos, na segunda metade do século XX e
agora, no início do século XXI, que ainda estão em
estudo mas ainda não conseguiram suplantar o
brilhantismo do gênio de Mendeleïev, nem obtiveram o reconhecimento pelos
órgãos científicos oficiais internacionais suficiente para
substituir sua tradicional tabela com as atualizações.
Roy Alexander :
modelo cilíndrico. Conhecido “designer”, criou esse modelo da Tabela
Periódica de Mendeleiev em forma de uma fita enrolada em forma de
cilindro.
De acordo com a idéia , haveria a vantagem de evitar quebras de linha existentes no modelo original.

Fernando
Dufour: modelo cônico. Químico canadense idealizou o modelo em forma de
árvore de Natal, com vários níveis que vão descendo em espiral em torno
de um eixo, cada círculo espiralado representando um dos períodos da
Tabela de Mendeleiev. Além disso, o autor dizia haver, para ele, uma necessidade de uma terceira dimensão para visualisar a tabela periódica.

Fichas periódicas : não chega
a ser um modelo de tabela. São apenas fichas ou plaquetas
de plástico presas por uma argola – cada uma traz o nome, a
abreviatura e o número atômico de um elemento.

Fonte:

Nenhum comentário:
Postar um comentário